Maladies rares, patients oubliés ?
En France, 3 millions de personnes sont touchées par l’une des 7000 maladies dites « rares ».
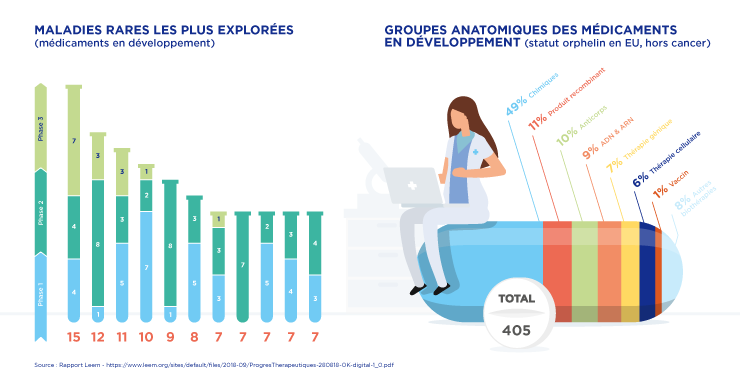
Chiffres
- Près de 200 médicaments ont obtenu à ce jour une autorisation de mise sur le marché (AMM) européenne dans le champ des maladies rares.
- 20% : C'est le pourcentage des essais cliniques en France qui concernaient les maladies rares en 2020 (sponsors industriels, enquête attractivité du Leem).
Contexte
● Une maladie est définie comme rare lorsque la proportion de malades atteints ne dépasse pas 5 pour 10 000 habitants, soit moins de 30 000 malades en France par pathologie.
On dénombre environ 7000 maladies rares différentes.
En France, 3 millions de personnes en sont atteintes, dont 75 % sont des enfants.
Les maladies rares sont le plus souvent des maladies d’origine génétique (dans 80 % des cas), sévères et d’évolution progressive, affectant fortement la qualité de vie des malades.
Ce sont des maladies complexes et hétérogènes par nature et 95% n’ont pas de traitement approuvé.
● La France favorise depuis longtemps un accès précoce aux traitements, tout en veillant à la sécurité des patients. Cette approche, soutenue par les entreprises du médicament, garantit l’accès aux thérapies les plus innovantes.
Enjeux
● Réduire l’errance diagnostique
Avant qu’un diagnostic soit posé sur sa maladie, une personne atteinte de maladies rares et sa famille rencontrent très fréquemment une longue période dite « d’errance diagnostique ». 4 ans c’est la moyenne de l’errance diagnostique, avec de très fortes disparités entre les différentes maladies.
Avec les 3 plans nationaux maladies rares (PNMR), l’organisation des soins est structurée en 23 filières nationales, 104 centres de référence coordonnateurs et 259 centres de référence constitutifs et 1267 centres de compétences. Cette organisation a permis d’améliorer la prise en charge de nombreux malades par le rôle de coordination de tous les acteurs impliqués.
● Conserver une position d’expertise française
La France a eu un rôle mobilisateur et doit le conserver. Elle a été pionnière dans le champ des maladies rares et fait figure de pays avant- gardiste. Les efforts entrepris pour fournir aux malades les meilleurs soins disponibles sont à poursuivre par la mise en œuvre toutes les mesures du troisième PNMR.
Depuis 1987, le Téléthon mobilise les Français autour de cette cause commune. Et, depuis 1996, le portail d’information Orphanet regroupe les ressources nécessaires aux patients concernés et à leurs proches : https://www.orpha.net/consor/cgi-bin/index.php?lng=FR
Il s’agit maintenant de réussir le troisième PNMR (2018-2022), au travers notamment des objectifs suivants :
o dépister plus précocement les maladies
o débuter les prises en charge au plus tard un an après la première consultation par un spécialiste (au lieu de cinq ans actuellement pour plus d’un quart des patients)
o faciliter la mise en place de nouveaux tests néonataux de dépistage
o renforcer la structuration des bases de données pour accroître le potentiel de recherche
o faciliter l’accès aux traitements utiles.
● Accélérer la recherche sur les thérapies géniques
La thérapie génique consiste à intégrer dans les cellules du malade un gène médicament destiné à résoudre l’anomalie responsable de la maladie. Plusieurs succès sont déjà à mettre sur le compte de la thérapie génique (dans la maladie de Duchenne par exemple).
Pour augmenter l’attractivité de la recherche clinique française, les enjeux actuels sont les suivants:
o mettre en place de très importantes capacités bio-informatiques d’analyse et de stockage des flux de données génomiques
o pérenniser les efforts de coopération entre les cliniciens, les académiciens, les associations de patients et les entreprises du médicament.
Nos Actions
● Grâce à l’implication de toutes les parties prenantes, les patients français sont souvent les premiers en Europe à pouvoir bénéficier de l’innovation apportée par les entreprises du médicament.
En effet, certaines situations urgentes, engageant le pronostic vital du patient, requièrent l’utilisation de traitements qui ne sont pas encore enregistrés : c’est particulièrement vrai pour les maladies rares.
L’autorisation de mise sur le marché (AMM), basée sur une analyse approfondie du rapport bénéfices/risques et régie par des règles strictes d’exploitation, reste le but ultime.
● Plusieurs milliers de molécules ont été désignées médicaments orphelins (Orphan Drug Designation) et près de 200 médicaments ont reçu une AMM sur le marché en Europe à ce jour. En 2020, 21 médicaments orphelins ont obtenu une AMM.
● Malgré les barrières de développement spécifiques aux maladies rares (absence quasi systématique de connaissances sur la maladie, faible nombre de malades, investissements R&D longs et risqués), les entreprises du médicament continuent à investir dans le développement de nouvelles thérapies pour les maladies rares.
En 2020, 20% des essais cliniques à promotion industrielle en France concernaient les maladies rares.
● Le Leem a publié le 29 février 2020 son livre blanc, détaillant ses engagements pour améliorer la recherche de traitements, leur production et leur accès aux patients.

