Le médicament et son écosystème d'innovation
Comment les entreprises du médicament gèrent-elles les questions éthiques et déontologiques ?
Le comité de déontovigilance de la profession, mis en place en 2011, a élargi sa saisine aux lanceurs d’alerte en 2017.
membres siègent au Codeem depuis octobre 2017 (contre 11 auparavant), parmi lesquels des experts en éthique et déontologie, des représentants des parties prenantes, des représentants des industriels et des magistrats.
« Le bénéfice, considérable, apporté par les médicaments développés au cours des cinquante dernières années ne saurait être contesté.
Dans le même temps, des réserves sont régulièrement formulées quant à la déontologie des relations entre les acteurs concernés : les firmes pharmaceutiques, qui sont à l’origine de ces progrès majeurs, les professionnels, notamment les médecins prescripteurs et les patients auxquels les médicaments sont destinés » soulignait le Pr Jean-Jacques Zambrowksi dans son rapport «L’éthique des relations de l’industrie pharmaceutique avec les professionnels de santé et les patients : évolution et analyse», rendu en 2007 (1).
Comme le souligne ce rapport, voici quelques éléments du dispositif législatif actuel :
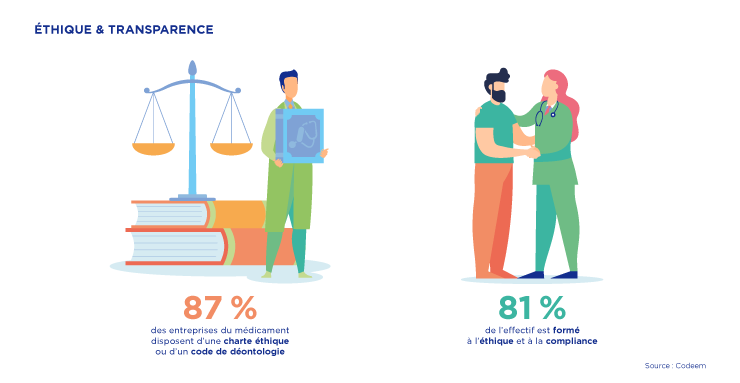
● La Charte de la visite médicale :
En 2003, les entreprises du médicament ont élaboré un référentiel des bonnes pratiques de la visite médicale visant à garantir la loyauté des comportements professionnels.
Dans la foulée, une charte de la visite médicale a été conclue le 22 décembre 2004 entre le Leem et le Comité économique des produits de santé (CEPS).
● La loi « anti-cadeaux » :
Selon les lois du 4 mars 2002 et du 26 février 2007 : « Est interdit le fait, pour les membres des professions médicales mentionnées au présent livre, de recevoir des avantages en nature ou en espèces, sous quelque forme que ce soit, d’une façon directe ou indirecte, procurés par des entreprises assurant des prestations, produisant ou commercialisant des produits pris en charge par les régimes obligatoires de sécurité sociale. Est également interdit le fait, pour ces entreprises, de proposer ou de procurer ces avantages ».
● Les codes de bonne pratique :
Etablis par l’Efpia (Fédération européenne des associations et industries pharmaceutiques) et la Fiim (Fédération internationale de l’industrie du médicament), ces codes mettent en place un cadre très concret et détaillé, définissant les pratiques autorisées et interdites. Par exemple, un voyage peut être offert à un professionnel de santé par un laboratoire pharmaceutique uniquement si la destination est justifiée par un motif scientifique légitime (congrès d’une société savante internationale par exemple).
En dehors de ce contexte limitatif, tout voyage vers une destination étrangère ou simplement touristique ne peut être offert à un médecin par une entreprise pharmaceutique.
● La publicité des produits pharmaceutiques :
« La loi (articles 5122-1 et suivants du Code de la santé publique) interdit la publicité directe des produits pharmaceutiques soumis à prescription obligatoire ("sur liste") et remboursables ("vignettés") auprès du grand public. Seule est donc autorisée, sauf mention contraire dans l'AMM (autorisation de mise sur le marché, ndlr), la publicité pour les produits non prescrits et non remboursables, correspondant donc à des médicaments d'automédication souvent appelés OTC par référence à leur mise à disposition devant le comptoir dans les pharmacies de certains pays étrangers » indique le rapport du Pr Zambrowksi.
Le Codeem
Mis en place en 2011 par le Leem, le Codeem (Comité de déontovigilance des entreprises du médicamen)t est une instance d’autorégulation de la profession.
Son objectif est de faire respecter les règles de déontologie et d’éthique de la profession.
Il a mis sur pied des dispositions déontologiques professionnelles (DDP), qui réunissent l’ensemble des engagements déontologiques applicables à la profession au 12 janvier 2016. Ces DDP intègrent et fusionnent de nombreux codes et chartes existant au niveau européen et/ou français (2).
Voici par exemple les dispositions qui s’appliquent à la transparence de la promotion : « La promotion doit être transparente. Les études cliniques, les études observationnelles et les études post-autorisation de mise sur le marché (y compris les études rétrospectives) doivent être conduites dans un but essentiellement scientifique ou pédagogique et non à des fins promotionnelles. Lorsque qu'une entreprise du médicament finance ou organise par d'autres moyens la publication dans un journal de documents promotionnels, le document concerné ne doit pas se présenter comme un texte éditorial indépendant. Tout matériel relatif aux médicaments et à leur usage, qu'il soit de nature promotionnelle ou non, doit, s'il est parrainé par une entreprise, clairement mentionner ce parrainage et l'identité du parrain ».
Encourager la transparence sur les liens d’intérêt
● Les liens d'intérêts contractés avec les entreprises du médicament dans le cadre de l’exercice professionnel doivent être publiés sur Internet (loi Bertrand de 2011).
Depuis 2014, les entreprises sont tenues de les déclarer sur la base Transparence-Santé du ministère des Solidarités et de la Santé (3).
La loi de santé de janvier 2016 a étendu ce principe de transparence en instaurant un régime de publication propre aux rémunérations.
Un décret, paru le 30 décembre 2016, oblige les professionnels de santé à rendre publiques davantage d’informations : les laboratoires sont désormais tenus de publier, pour chaque convention, son objet précis, sa date, son bénéficiaire direct et son bénéficiaire final, et surtout son montant et les rémunérations associées.
Répondre aux nouvelles questions éthiques
● L’accélération de l’utilisation du big data et de l’intelligence artificielle en santé entraîne de nombreuses questions éthiques : quelles sont les limites à la valorisation des données massives récoltées à partir de données individuelles ? Comment évoluent les responsabilités dans le cadre du développement de la médecine connectée ? Quelles exigences pour l’éducation thérapeutique du patient ? Quelles limites face aux tests individualisés, génétiques notamment ?
En 2017, le Codeem a notamment mené les actions suivantes (4) :
● Il a donné un avis sur la clarification, au plan éthique, de la frontière entre information médicale et promotion, au regard de l’évolution des rôles et obligations des référents médicaux en région (MSL) lors de leurs relations avec les professionnels de santé
● il a élargi sa composition avec de nouveaux membres et de nouvelles compétences
● il a réuni sa commission de déontologie à dix reprises
● il a traité des informations suivantes : information directe aux patients, rôle et missions des référents médicaux en région (MSL), e-santé, protection des lanceurs d’alerte, transparence des liens
● il a répondu à des demandes d’avis et de conseils concernant des adhérents du Leem et à deux saisines majeurs du président du Leem
● il a tenu une conférence de presse et organisé une réunion d’information des adhérents du Leem
● il a travaillé en lien avec ses homologues au niveau européen et national
Par ailleurs, la saisine du Codeem a été élargie aux lanceurs d’alertes, sous certaines conditions, en application de la loi dite « Sapin II » du 9 décembre 2016, relative à la transparence de la vie économique et des procédures publiques.Voici les mesures prévues :
● le Codeem encourage les adhérents du Leem à mettre en place une procédure qui gère l’alerte et protège le salarié lanceur d’alerte ;
● il invite les entreprises à communiquer en interne au sujet de cette loi ;
● il propose d’ouvrir la saisine de sa commission de déontologie à tout lanceur d’alerte s’agissant des violations des dispositions déontologiques professionnelles (DDP).