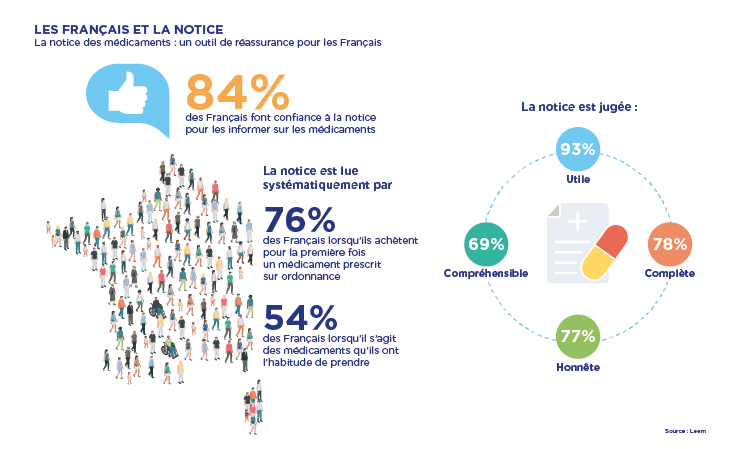
Le médicament et sa mise au point
Pourquoi les notices des médicaments sont-elles si compliquées à comprendre ?
Elle est la traduction dans un langage adapté aux utilisateurs de l’ensemble des informations connues et validées par les autorités de santé.
La notice doit intégrer à la fois des contraintes réglementaires et la complexité de certains médicaments.
● La notice est le document d’information accompagnant le médicament et destiné spécifiquement à l’utilisateur. Elle est obligatoire. (1)
● Elle fait partie du dossier que soumettent les entreprises pharmaceutiques aux autorités de santé avant la mise sur le marché d’un médicament, et contient les informations essentielles sur le médicament.
● Comme les autres éléments de ce dossier, elle est évaluée par les experts de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) ou de l’Agence européenne du médicament (EMA).
● Depuis 2006, les industriels se livrent à des tests de lisibilité auprès de groupes cibles de patients pour s’assurer qu’ils sont capables, d’une part, de trouver l’information (lisibilité), d’autre part, de la comprendre (clarté) et, enfin, de la mettre en application (facilité d’utilisation).
Les résultats de ces tests permettent d’adapter les notices en conséquence.
- (1)Article R. 5141-76 du Code de la santé publique
● La notice est bien plus qu’un simple mode d’emploi mis à la disposition du patient. C’est un élément important de la sécurité des soins.
● Son contenu doit répondre à un certain nombre de règles strictes et refléter le contenu de l’autorisation de mise sur le marché.
Elle décrit notamment le nom du médicament, le dosage, la forme pharmaceutique, les indications thérapeutiques, les informations relatives aux contre-indications, précautions d’emploi et interactions médicamenteuses, la posologie, le mode et la voie d’administration, la description des effets indésirables.
● De façon générale, elle contient aussi la conduite à tenir en cas de grossesse, les effets du médicament sur la conduite des véhicules ou encore les modalités de récupération des médicaments non utilisés et des emballages vides.
● La quantité d’informations contenues, les contraintes réglementaires, mais aussi la complexité de certains médicaments, ne facilitent pas toujours la traduction en un langage clair et compréhensible.
Les industriels et les autorités de santé doivent travailler ensemble pour les rendre plus pédagogiques.
● Les entreprises du médicament ont procédé à une clarification réalisée par étapes successives pour faire évoluer la rédaction et la compréhension des notices : emploi de caractères de taille et de police faciles à lire, utilisation d’un papier adapté, rédaction de paragraphes et de phrases courtes, recours à des interlignes et des espacements suffisants...
● Elles réalisent auprès des patients ces tests de lisibilité pour les nouvelles autorisations de mise sur le marché (AMM), les renouvellements d’AMM et avant chaque changement substantiel dans la notice.
Les entreprises pharmaceutiques doivent, de plus, faire figurer sur l’emballage de tous les médicaments le nom et le dosage en braille et fournir, sur demande, des notices adaptées aux malvoyants.
● Les industriels actualisent très régulièrement leurs notices : celles-ci sont modifiées chaque fois qu’on dispose de nouvelles connaissances sur un médicament. C’est pour cela qu’elles comportent une date d’actualisation.
● Les industriels, en partenariat avec les autorités de santé européennes, travaillent à l’élaboration d’une notice dématérialisée qui viendra en complément de la notice papier.
Cette e-notice permettra des mises en jours quasiment en temps réel, et facilitera l’accès à l’information, y compris pour les patients ayant des déficiences visuelles (utilisation de caractères de grande taille, par exemple) et ceux présentant un faible niveau d’alphabétisation (formats sonores, par exemple).