Microbiote : le deuxième cerveau va-t-il permettre de mieux soigner les patients ?
Ces dernières années, les recherches dans ce domaine ouvrent de nouvelles voies prometteuses pour comprendre l’origine de nombreuses maladies. (Maj : 19.01.2023)
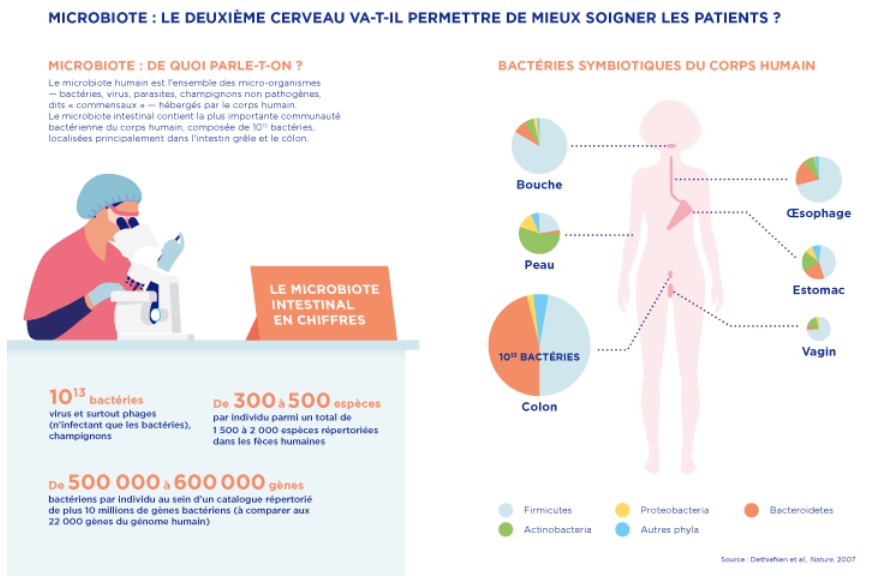
Chiffres :
500 000 à 600 000 : C'est le nombre de gènes bactériens que chaque individu héberge en moyenne (il y a environ 22 000 gènes dans le génome humain).
Contexte :
● C’est le microbiote intestinal qui contient la plus importante communauté de micro-organismes du corps humain, avec 1012 à 1014 micro-organismes : deux à dix fois plus que le nombre de cellules constituant notre corps, pour un poids de 2 kg !
● Le microbiote d’un individu se constitue dès sa naissance, au contact de la flore vaginale après un accouchement par voie basse, ou au contact des micro-organismes de l’environnement pour ceux nés par césarienne.
Le microbiote est propre à chaque individu.
● Le microbiote intestinal contribue à la digestion de nos aliments et à notre métabolisme. Il est également capable de fabriquer des molécules indispensables à notre survie, comme les vitamines B12 ou K, de moduler l’absorption des sucres et des lipides, et assure une protection efficace contre la colonisation par des bactéries pathogènes.
Cet effet barrière s’appuie sur un ensemble de mécanismes complexes.
● De plus en plus d’études montrent une corrélation entre la diversité du microbiote, le mode de vie et la survenue de pathologies inflammatoires ou métaboliques chroniques.
Ainsi, la diversité en espèces, et donc en gènes microbiens, est réduite chez les individus atteints d’une pathologie chronique, comparée à celle de sujets en bonne santé.
L’altération qualitative et fonctionnelle du microbiote, connue sous le nom de dysbiose, serait à l’origine de nombreuses maladies comme les maladies chroniques inflammatoires, le diabète, l’obésité ou encore la dépression.
● La transplantation fécale a été reconnue comme un médicament en France.
Le principe est d’inoculer des selles humaines, provenant d’un individu sain (le donneur) à un malade (le receveur). La seule indication acceptée actuellement concerne les diarrhées à Clostridium difficile résistantes aux antibiotiques.
Plusieurs essais cliniques sont en cours pour tester la transplantation fécale dans d’autres pathologies, comme la maladie de Crohn, le syndrome de l’intestin irritable ou les maladies du foie.
Enjeux :
● La caractérisation complète du métagénome, considéré comme notre « autre » génome est une étape clé de la compréhension de la physiologie humaine.
● Faire la preuve d’un lien de causalité entre certaines maladies et le microbiote
Le rôle du microbiote est largement évoqué dans plusieurs maladies neuropsychiatriques : l’autisme, l’anxiété et la dépression.
D’autres études ont suggéré un rôle important du microbiote dans les maladies neurodégénératives : il serait impliqué dans l’inflammation cérébrale de la maladie d’Alzheimer, en participant à la formation des plaques amyloïdes.
Des études très récemment publiées ou en cours suggèrent des pistes précises impliquant des métabolites produits par certaines souches bactériennes. Il reste à confirmer ces hypothèses.
● Confirmer les pistes thérapeutiques
La dysbiose étant mise en cause dans certaines maladies, restaurer la flore par l’alimentation, par l’apport de pré ou probiotiques, est une piste explorée depuis de nombreuses années.
Mais, pour le moment, seuls quelques probiotiques, et avec des niveaux de preuve clinique assez faible, ont véritablement démontré un effet bénéfique pour la santé de l’homme.
● Par ailleurs, le microbiote intestinal, qui joue un rôle clé à distance sur le métabolisme et le système immunitaire via ses métabolites, peut donc influencer la réponse aux traitements.
Le métabolisme de certains médicaments, dont la digitaline, des anticancéreux et les statines, pourrait être modifié par la composition du microbiote.
On peut donc penser qu’à terme, les interventions thérapeutiques pourraient être déterminées en fonction de la composition de ce dernier.
● L’analyse du microbiote pourrait devenir un outil de stratification des patients, permettant de surveiller l’évolution de la maladie (par exemple, les maladies inflammatoires chroniques intestinales) et l’état de santé des patients.
On pourrait aussi stratifier les répondeurs et les non répondeurs aux traitements.
Nos Actions :
● Les entreprises du médicament nouent de nombreux partenariats avec des start-up travaillant sur le microbiote, notamment dans la recherche de biomarqueurs de maladies inflammatoires.
● Ces collaborations devraient aussi permettre aux entreprises du médicament de rendre leurs traitements plus efficaces car ciblant plus précisément les maladies du côlon.
● Elles suivent activement les recherches sur le microbiote puisqu’il est déjà démontré que l’efficacité d’un médicament contre le diabète dépend de son interaction avec le microbiote intestinal et l’alimentation.

