Recherche clinique : la France stagne, l’Europe recule - Comment préserver l’innovation ?
Les résultats de l’enquête annuelle sur l’attractivité de la France pour la recherche clinique[1] sont sans appel. Avec un 3ᵉ rang européen, cette position exprime une stagnation préoccupante, tandis que l’Europe perd du terrain face aux grandes puissances mondiales.
Un signal d’alerte pour l’accès à l’innovation
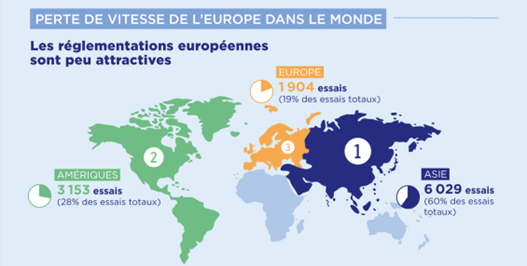
C’est une réalité : l’innovation est désormais principalement développée hors Europe. Avec seulement 19 % des essais mondiaux, l’Europe est le troisième territoire, loin derrière le continent américain et l’Asie (respectivement 28 % et 60 % des essais mondiaux). La France, quant à elle, stagne au sein de l’Europe derrière l’Espagne et l’Allemagne, et conserve sa troisième place uniquement grâce aux essais de phase précoce en oncologie. Ce sont des signaux inquiétants qui mettent en danger l’accès des patients aux innovations thérapeutiques, en particulier dans des domaines critiques tels que l’oncologie, les maladies rares et les médicaments de thérapie innovante. Sans des changements rapides, ce sont les patients européens – et en particulier les patients français – qui risquent d’être pénalisés.


Pour un leadership retrouvé
Retrouver un leadership européen n’est plus une option, c’est un besoin. Dans son rapport sur la compétitivité européenne présenté le 9 septembre dernier, l’ancien Premier ministre italien Mario Draghi avait déjà alerté sur la perte de vitesse de l’Europe par rapport à d’autres régions du monde et présenté des recommandations pour une nouvelle stratégie industrielle. Le secteur pharmaceutique y était largement reconnu comme un pilier stratégique – contributeur à la R&D et à la balance commerciale – dans lequel l'Europe doit s’investir davantage.
L’enjeu est le même au niveau national. Plusieurs pays européens ont déjà mis en place des procédures facilitatrices : fast track national, intégration des pratiques de décentralisation... L’Allemagne va encore plus loin avec son nouveau german medical research act et des mesures en faveur du développement de l’innovation en santé (accélération des autorisations, clauses standards pour les contrats, simplification de la décentralisation, instauration d’un lien entre le prix et la présence des essais cliniques).
« La France et l’Europe possèdent un potentiel considérable en recherche clinique. Cependant, les lourdeurs administratives et l’accumulation des réglementations freinent notre compétitivité. La France ne doit pas continuer à se laisser distancer par ses concurrents européens. Il est impératif d’agir rapidement pour simplifier, accélérer et harmoniser les processus, afin de garantir aux patients français un accès rapide aux innovations », déclare Thierry Hulot, président du Leem.
Des réformes urgentes
Les raisons de la perte de leadership de l’Europe – et de la France – sont connues : un environnement moins favorable, des procédures et un cadre réglementaire complexes, des délais longs… Pourtant, la situation n’est pas immuable. Pour rappel, il y a seulement 10 ans, notre pays était le leader européen de la recherche clinique. Redonnons-nous des chances en misant sur l’innovation !
Nous proposons :
- la mise en place, pour les essais les plus innovants, d’un fast track européen pour réduire les délais d’autorisation des essais cliniques à 31 jours au lieu de plus de 100 jours actuellement,
- une meilleure interface des réglementations européennes (notamment entre le médicament et le diagnostic in vitro),
- au niveau national, une simplification de la contractualisation (approche forfaitaire par visite de patient dans la convention unique),
- une accélération de la décentralisation et de la digitalisation des essais afin de faciliter la recherche clinique à domicile, au plus près des patients.
Le projet de loi de simplification de la vie économique, qui sera prochainement examiné à l’Assemblée nationale, est une première étape nécessaire pour parvenir à un cadre attractif pour les industriels du médicament.

Téléchargez l’étude et les infographies ci-dessous
--------------------------------------------------------------------------------------------------------------------------------------------------------------------
Contacts Presse :
Stéphanie BOU - 06 60 46 23 08 sbou@leem.org
Virginie PAUTRE - 06 31 86 82 70 - vpautre@leem.org
Célina FERNANDES – 06 08 97 50 49 - cfernandes@leem.org
[1] Du 1er janvier 2023 au 30 juin 2024

