Chantier 1 : un accès des patients à l'innovation le plus précoce possible
Vers de nouvelles pratiques de recherche et d’essais cliniques
Avec le retour de l'innovation, les pipelines des entreprises de santé accumulent des quantités phénoménales de nouvelles molécules.
Cette multitude de traitements potentiels complexifie également les thérapeutiques possibles.
En oncologie, l'arrivée de l'immunothérapie a ainsi multiplié les approches.
La chimiothérapie peut désormais se combiner à la chirurgie, à la radiothérapie, à des thérapies ciblées et à l'immunothérapie.
Les progrès sont très rapides dans ce domaine, et certains traitements ou combinaisons peuvent être qualifiés ou déclassés par rapport à d'autres en l'espace de quelques mois. Or, pour être autorisée, toute nouvelle molécule ou stratégie thérapeutique doit passer par une batterie de tests et d'essais cliniques menés sur l'homme, qui sont longs et coûteux.
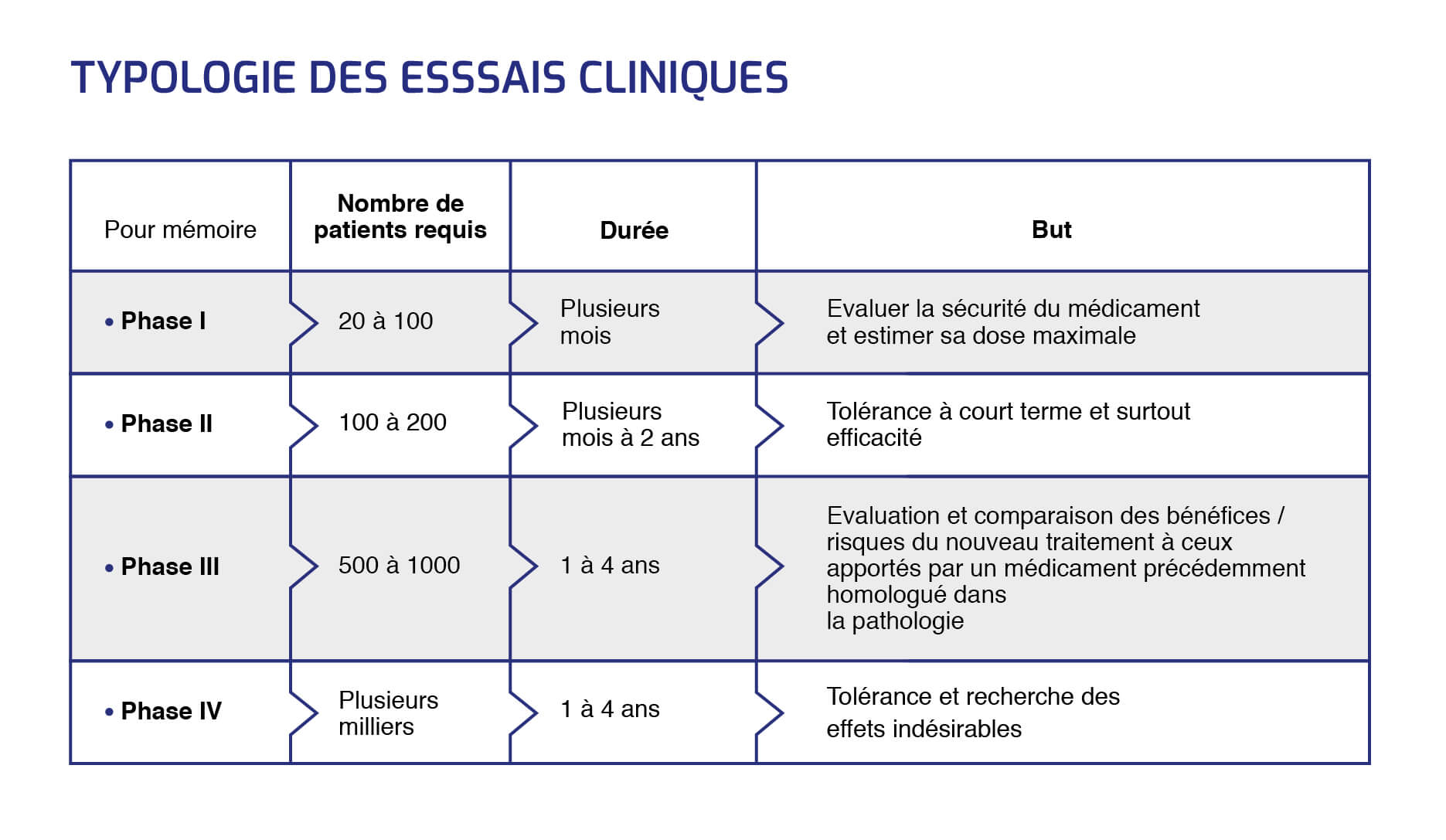
Traditionnellement, les essais cliniques se déroulent en trois phases distinctes, consécutives, et dont les modalités décidées à l'avance semblent encore aujourd'hui immuables.
"L’ensemble de ces trois phases prend environ dix ans et coûte entre 1 et 2 milliards de dollars", souligne Aurélien Marabelle, directeur clinique du programme d'immunothérapie de l'Institut Gustave Roussy, investigateur principal du Département d'innovation thérapeutique et d'essais précoces.
Les acteurs, chercheurs et industriels savent que ce schéma n'est pas adapté à l'innovation expérimentale : il faut davantage de souplesse, de rapidité (à quoi servirait un essai clinique nécessitant plusieurs années pour un traitement qui apparaîtrait déjà déclassé par une innovation ?).
Il faut permettre l'accès aux traitements rapidement (pour les patients en situation critique), et faciliter l'usage des connaissances développées au cours de l'essai, de manière continue, car celles-ci participent directement de l'évaluation de la performance de la solution.
De plus, la multiplication des essais cliniques en cours et à venir est liée aux progrès en oncologie, avec, notamment, l'avènement des thérapies ciblées (qui ciblent les cellules tumorales) et de l'immunothérapie (qui cherche à améliorer la réponse globale du système immunitaire, de façon à ce que les défenses immunitaires éliminent elles-mêmes toute cellule cancéreuse).
Dans un cas comme dans l'autre, il n'est plus question de classer les cancers par l'organe qu'ils touchent.
Les essais peuvent donc inclure des patients présentant des cancers distincts les uns des autres.
"C'est la cartographie génétique de la tumeur, et non le diagnostic histologique, qui va permettre de décider de l'inclusion d'un patient. Certains agents d'immunothérapie sont efficaces sur une trentaine de cancers, mais n'ont l'autorisation de mise sur le marché que dans cinq d'entre eux", témoigne Aurélien Marabelle.
Or, les essais cliniques traditionnels se concentrent sur une seule molécule dans une seule maladie (on parle d'indication), et ne sont donc plus compatibles avec la logique des innovations expérimentales.
Un nouveau dispositif à développer : les essais adaptatifs
Il s'agit de développer des essais adaptés à l'exploration de ces nouvelles thérapies (et demain d'un nombre croissant de solutions santé).
L'objectif : accumuler de l'information au fur et à mesure et réagir aussitôt pour redresser la situation et améliorer la précision.
Les modifications de l'essai sont possibles, alors que l'inclusion des patients se poursuit encore.
"On peut modifier le design de l’étude en fonction des signaux d’efficacité et de tolérance qui apparaissent au cours de l'essai", indique Frédéric Fleury, spécialiste des essais cliniques en oncologie chez Roche Pharma France.
La cohorte de patients testés étant elle aussi mieux définie, sa taille peut être réduite.
"Globalement, on divise par trois le nombre de patients qu'il est nécessaire d'inclure dans l'essai ", précise-t-il.
Vision 2030
Cette phase reposera sur des études observationnelles évaluant des schémas thérapeutiques adaptés à chaque patient (pharmaco-génomique) réalisées en centres spécialisés de type CHU ou IHU ; Il faudra aussi accélérer la mise à disposition de traitements innovants tout en garantissant leur sécurité d’emploi et en assurant des équilibres de financement pérenne des innovations à venir.
|
(Chantier 1 "Permettre l'accès le plus précoce possible des patients à l'innovation, en adoptant une approche plus individualisée de la recherche clinique").
Extrait de Santé 2030 - Partie 4 : 10 chantiers pour construire 2030. Retrouvez l'intégralité de l'étude sur le site.

