La nanomédecine
De quoi parle-t-on ?
Au début du XXe siècle, le scientifique allemand Paul Ehrlich théorisait l'idée du "magic bullet" : une "balle magique" qui serait spécifiquement dirigée et active contre les agents infectieux au sein de l'organisme. Ce concept est aujourd'hui une réalité grâce à la vectorisation des médicaments permise par les nanotechnologies.
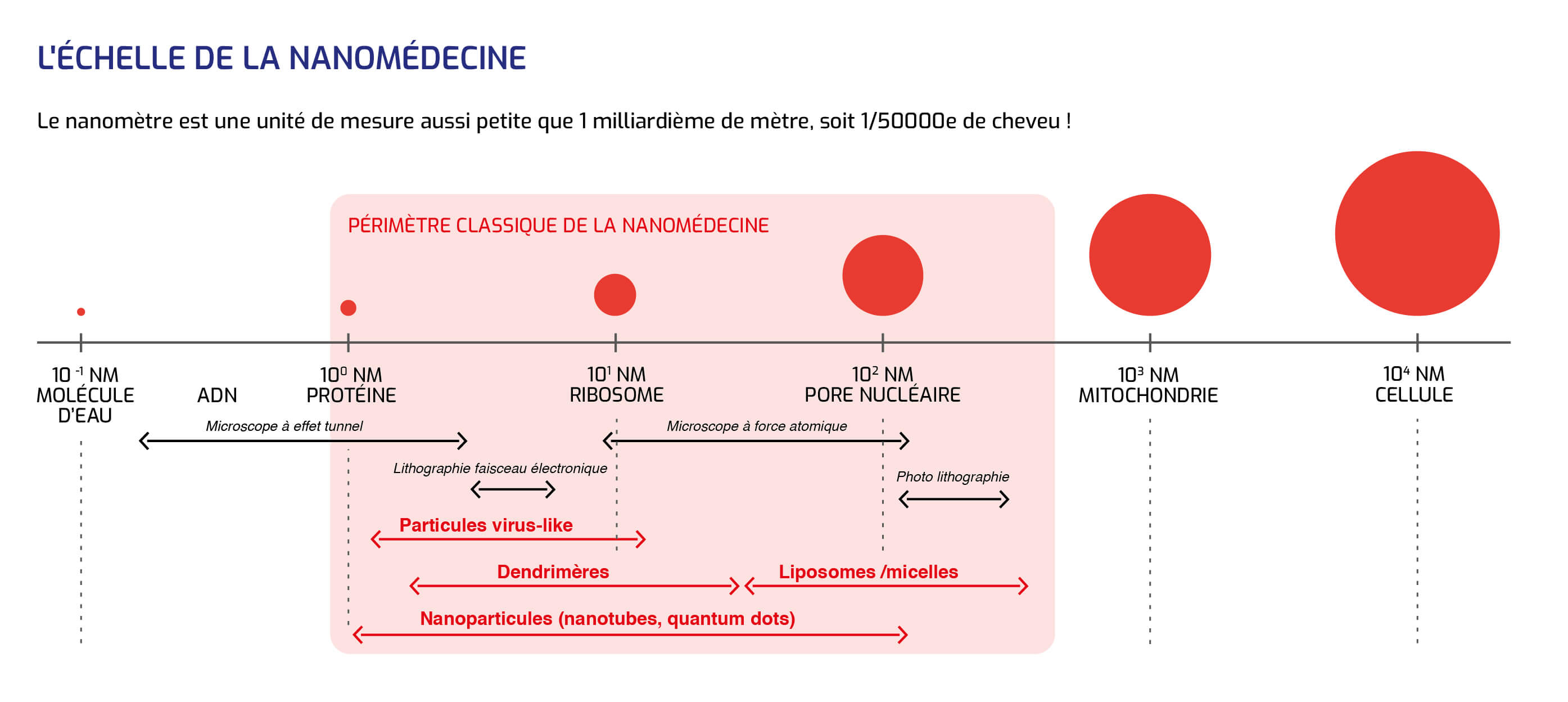
Disposer de matériaux à l'échelle du nanomètre permet en effet d'agir à l'intérieur de cellules et de bénéficier de compétences totalement nouvelles, deux facteurs générateurs d'innovation
Ce qui se profile d'ici 2030
Les applications de la nanomédecine rendront la prise en charge des maladies plus précise et plus adaptée.
Elles se révèlent très précises par leur capacité à interagir de façon ciblée avec les tissus, les cellules, et même les molécules. A l'échelle "nano", certaines substances ou matériaux peuvent changer de propriétés et devenir plus résistants, plus réactifs...
D'autres, comme les nanocristaux, provoquent une meilleure dissolution du principe actif que le principe actif seul.
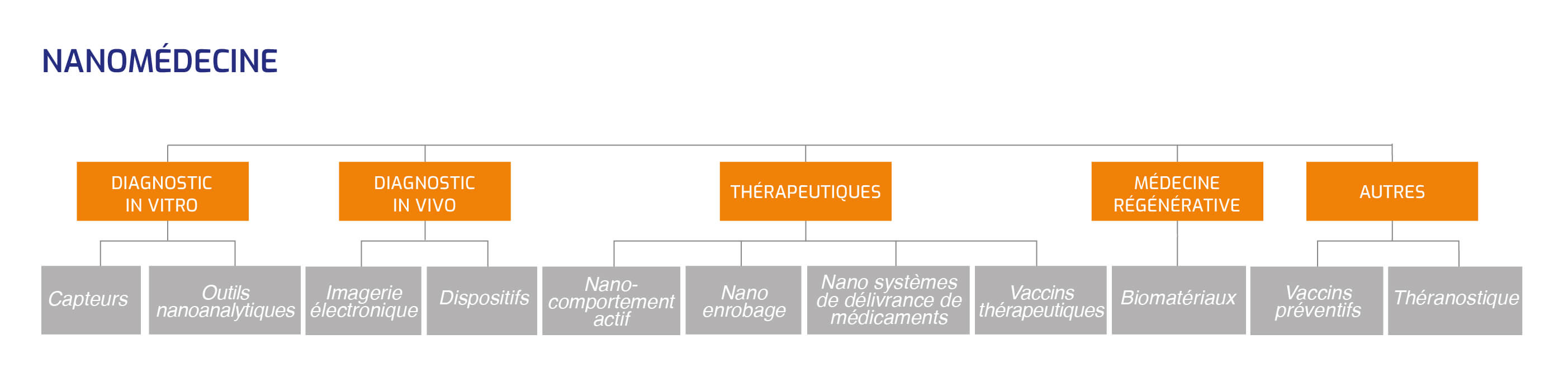
Globalement, les nanotechnologies permettent le développement de nouvelles techniques médicales de diagnostic, de thérapie et de suivi des patients.
Les développements scientifiques d'aujourd'hui en nanomédecine permettront d'apporter de nouvelles réponses technologiques et d'améliorer considérablement les traitements à l'horizon 2030.
Les apports de la nanomédecine d'ici 2030
• Des nano-objets capables de leurrer le système immunitaire pour mieux traiter certaines pathologies.
• Des nano-objets capables d'activer le système immunitaire afin de restaurer une réponse de l'organisme contre une pathologie.
• Des nanovecteurs ciblés spécifiques à certains types cellulaires pour libérer une substance active sans induire de toxicité dans d'autres types cellulaires.
• Des nano-objets portant un label fluorescent ou radioactif :
- capables de détecter précocement des perturbations fonctionnelles ;
- permettant d'apporter une aide à la chirurgie guidée par l'image.
Les nanotechnologies permettront aussi de concevoir des nanocomposés contournant les phénomènes de rejet pour les greffes ou la médecine régénérative.
Les nanomédecines seront également très utiles dans l'imagerie, en permettant "d'allumer" une tumeur et de la rendre ainsi plus facilement visible par IRM.
Ce qui amène d'ailleurs à une technique particulièrement novatrice, bien qu'encore au stade de la recherche expérimentale : la "nano-théranostique", ou la capacité à combiner au sein de la même nano¬particule administrée un médicament et un agent d'imagerie.
On va être capable de soigner, tout en visualisant le parcours des particules et ainsi s'assurer qu'elles atteignent bien les zones ciblées dans l'organisme.
La théranostique permet aussi de visualiser l'accumulation de nanoparticules puis de déclencher localement la libération du principe actif avec, par exemple, des microbulles activables sous ultrasons.
Des essais sont aussi conduits pour vectoriser des micro-ARN, c'est-à-dire des petites séquences de nucléotides.
Autre enjeu : réussir à cibler le tissu cérébral, en franchissant la barrière hémato-encéphalique.
Si cette dernière est indispensable à la protection du système nerveux central, elle constitue un frein au traitement de pathologies localisées dans la boîte crânienne.
Avec l'évolution des outils neurochirurgicaux, l'application de nouvelles nanomédecines dans le traitement de cancers cérébraux représente un axe de recherche prometteur.
Ce qui est en cours
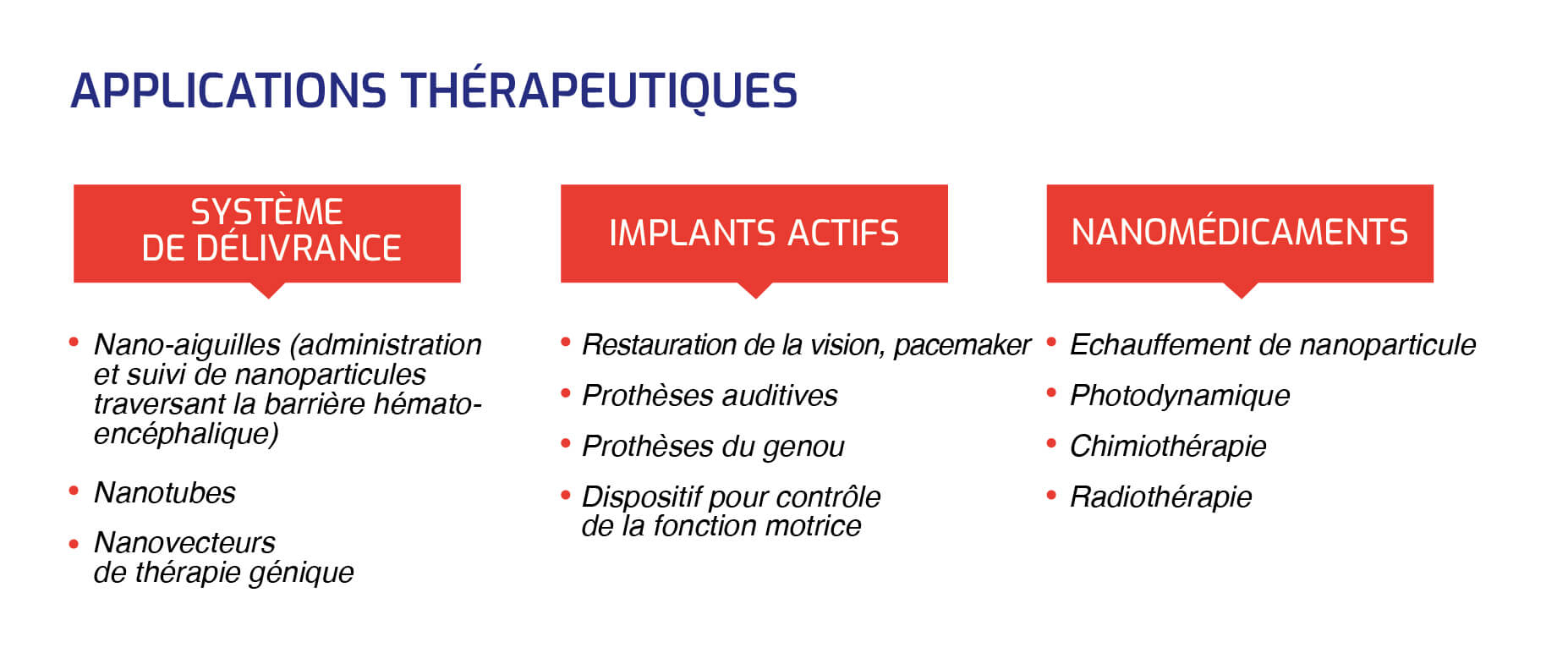
► L'utilisation de nanovecteurs, capables de transporter puis de libérer la substance active du médicament dans les cellules cibles, notamment dans le cas du cancer ou de pathologies inflammatoires, et de nano-objets, à même d'amplifier l'effet de la radiothérapie en préservant les tissus sains et l'amélioration du diagnostic.
L'utilisation de nanovecteurs
La nanomédecine offre aujourd'hui des réponses aux difficultés rencontrées par la thérapeutique classique.
Elle consiste à intégrer un principe actif dans un vecteur (micelle, liposome, enveloppe de polymère), ou à utiliser des nanomatériaux minéraux (nanoparticules d'or, silicium poreux...) pour adresser spécifiquement ce médicament à un tissu cible, sans qu'il soit distribué ailleurs dans l'organisme.
La vectorisation peut aussi concerner un principe actif, dont les propriétés physico-chimiques l'empêchaient jusqu'à présent d'être administrable tel quel. Porté par le nanovecteur, le principe actif est en outre protégé par une dégradation biologique avant d'atteindre son tissu cible.
Il peut enfin être "déclenché" ou libéré de façon progressive dans le temps : pour cela, on l'associe à un nanocomposé activable sous l'influence d'un signal (laser, rayons X, ultrasons...).
Les nanomédicaments améliorent donc le rapport bénéfices/risques des médicaments en augmentant leur efficacité et leur biodisponibilité au niveau du tissu ou de l'organe cible, tout en réduisant les doses à administrer et le risque de toxicité.
Potentiellement, ce type de nanomédecine pourrait concerner de nombreuses maladies.
C'est cependant pour le cancer qu'elle est le plus avancée : 9 nanomédicaments sont déjà commercialisés à travers le monde.
Des essais cliniques sont actuellement menés pour 15 autres produits, dont 5 ont atteint la phase III.
Ce type de traitement offre en effet deux avantages majeurs dans la lutte contre le cancer. Plus ciblé, il lèse moins les tissus sains que les chimiothérapies et les rayonnements.
Et pénétrant au cœur des cellules tumorales, le principe actif se montre plus efficace. Toutefois, des limites subsistent : les nanovecteurs ne peuvent être distribués dans les tumeurs que si celles-ci sont vascularisées, ce qui implique de le déterminer au préalable afin de proposer une médecine personnalisée. De plus, le cœur nécrosé des tumeurs ne permet pas toujours de délivrer un principe actif, cela nécessite de combiner des thérapies pour éviter la récidive tumorale.
Ces nanoparticules sont injectées dans le système sanguin du patient, via une perfusion par exemple. Les nanoparticules acheminent leur cargaison vers les cellules cancéreuses, ce qui évite la majorité des effets délétères que pourrait avoir le médicament sur les tissus sains.
Par ailleurs, lorsqu'une substance active se présente sous la forme d'un nanomédicament, elle est encapsulée, donc protégée contre la dégradation tout au long de son voyage dans l'organisme.
La voie d'administration actuellement la plus rapportée est la voie systémique, toutefois, les nanoparticules étant reconnues comme des particules du non-soi, elles vont être prises en charge par les cellules du système immunitaire pour être dégradées et éliminées par le foie.
Pour remédier à ce problème, les chercheurs procèdent à une simple modification de la surface des nanoparticules, ce qui permet de les rendre "furtives" vis-à-vis de nos défenses immunitaires.
De nombreuses stratégies visent à augmenter le temps de circulation des particules injectées par voie systémique.
En effet, si l'on souhaite atteindre des tumeurs vascularisées, le fait d'augmenter la durée de vie des particules dans le sang permet d'augmenter la quantité de particules accumulées dans les tumeurs.
Reste cependant à en acheminer une quantité maximale jusqu'aux cellules cancéreuses.
Les chercheurs doivent cette fois-ci encore faire preuve d'innovation dans ce domaine, car aujourd'hui, la quantité accumulée dépasse rarement 5 % de la dose injectée. La majorité de la dose est retrouvée dans le foie, ce qui limite les injections répétées (risque de toxicité).
L'amélioration en continu des nanovecteurs
La découverte d'une équipe française menée par le professeur Patrick Couvreur
Au lieu d'encapsuler la molécule de médicament, elle a imaginé de la relier par un lien chimique à un transporteur, le squalène, un lipide naturel présent dans la peau humaine, l'huile d'olive ou la graisse de baleine. Ce lipide, couplé à une molécule médicamenteuse et placé dans l'eau, forme spontanément des nanoparticules.
Une fois "squalénisé", le vecteur peut transporter jusqu'à 50 % de médicament vers la cellule ou le tissu à traiter, contre 1 à 5 % pour une capsule classique.
Des tests réalisés avec un anticancéreux sur des modèles de tumeurs animales (cancer du pancréas, du côlon, leucémie) ont démontré une efficacité bien plus importante que le médicament classique.
Des tests aussi probants ont été effectués avec une autre molécule utilisée dans le traitement des AVC. Dans les deux cas, le taux de médicament retrouvé dans la circulation est bien plus élevé.
Les autres voies de recherche
Ajouter à la surface des nanoparticules des molécules reconnaissant uniquement les cellules cancéreuses.
Les chercheurs explorent cette piste de nanoparticules de troisième génération, avec comme objectif de cibler des cellules souches cancéreuses hautement résistantes à la chimiothérapie classique.
Associer aux nanomédicaments des méthodes physiques permettant d'augmenter la vitesse et la quantité de médicaments libérées au niveau de la tumeur.
Ainsi, l'administration du médicament peut être déclenchée à distance par l'émission d'ultrasons.
Des nano-objets pour amplifier l'effet de la radiothérapie
Les nanomédicaments sont aussi utilisés comme source de chaleur pour augmenter l'efficacité des traitements classiques de radiothérapie ou chimiothérapie.
En effet, lorsque les cellules du corps sont exposées à des températures supérieures à la normale, des changements se produisent, les rendant plus sensibles aux effets des séances de rayons ou de l'administration d'une chimiothérapie.
La société française Nanobiotix a ainsi conçu une nanoparticule baptisée NanoXray, constituée d'oxyde d'hafnium.
Ce composé est capable d'émettre de nombreux électrons lorsqu'il reçoit des rayons X. Cela provoque un échauffement et amplifie ainsi de façon importante l'efficacité de la radiothérapie sur une tumeur, dans le but de réduire la dose nécessaire de radiations.
La société française NH TherAguiX propose également des nanoparticules, à base de gadolinium cette fois, pour potentialiser l'effet de la radiothérapie.
Ces nanoparticules injectées par voie intraveineuse, < 5 nm, et visibles par IRM, sont extrêmement prometteuses.
L'équipe du Dr Nathalie Mignet a également montré le potentiel pour l'imagerie de la fonction rénale de ces nanoparticules.
L'amélioration des outils de diagnostic actuels
De nombreuses techniques d'imagerie (radiographie, IRM, scintigraphie...) reposent sur le suivi de l'évolution de produits de contraste injectés dans l'organisme.
Les nanoparticules représentent une alternative intéressante aux agents actuellement utilisés (fluorures organiques ou isotopes radioactifs), car elles pourraient améliorer la résolution et la spécificité des images obtenues, tout en étant mieux tolérées par l'organisme.
Aujourd'hui, les propriétés des nanoparticules sont déjà exploitées dans le cadre de L'imagerie par résonance magnétique (IRM), qui utilise des nanoparticules d'oxyde de fer pour certaines applications. Les recherches se poursuivent afin d'étoffer le panel des agents disponibles et des techniques d'imagerie éligibles à ces agents.
Les nanomédicaments apportent de nombreux bénéfices
Les nanomédicaments sont soumis aux mêmes contraintes réglementaires que les médicaments classiques avant attribution d'une autorisation de mise sur le marché (AMM), impliquant particulièrement l'évaluation du service médical rendu et des effets indésirables éventuels.

Ce qu'il faut dépasser
Accélérer les applications médicales des nanotechnologies
Le nombre de brevets déposés en France n'est pas négligeable.
Mais, il faut bien reconnaître qu'aujourd'hui, les applications médicales des nanotechnologies sont encore peu développées globalement.
Les entreprises restent réticentes, mais elles font des nanos sans le dire, la difficulté majeure étant la production et la caractérisation pour pouvoir passer les réglementations de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
La France doit se structurer dans ce domaine, disposer d'un laboratoire dédié, semblable au NCL américain , avec des laboratoires reconnus pour valider les nanotechnologies.
Il faut s'appuyer sur les groupes existants, la Société française de nanomédecine, qui met en contact industriels et chercheurs, et utiliser son tissu existant de collaborations.
En d'autres termes, il faut construire un réseau français actif.
Ces chercheurs s'adressent ensuite à l'Agence nationale de la recherche (ANR), qui a financé de nombreux projets en nanotechnologies, ou à l'Europe, dans le cadre de son programme dédié baptisé Nanomed.
Enfin, la plupart des nanomédecines sont inscrites en "medical devices" pour faciliter leur mise sur le marché, d'où la difficulté de les trouver.
Progresser dans le champ de la nanotoxicologie
Le développement récent des nanomatériaux en dehors du domaine médical (cosmétique, alimentation...) avec un manque de recul et d'études toxicologiques et épidémiologiques dans ces applications, crée un halo de défiance sur l'ensemble des nanotechnologies dans l'opinion publique.
Les progrès en nanotoxicologie seront essentiels non seulement pour répondre aux questions propres au domaine de la nanomédecine, mais surtout pour appréhender les risques hors médecine des expositions par voie cutanée, digestive ou respiratoire aux nanoparticules.
Malheureusement, les études sont difficilement comparables et rarement utilisables : un réseau avec des méthodes qualifiées serait nécessaire.
Répondre au questionnement philosophique et éthique soulevé par l'utilisation des nanotechnologies
Manipuler et utiliser les nanomatériaux a un impact sur le vivant et l'environnement.
A mesure que ce domaine s'étoffe et que les applications se multiplient, la société civile et les chercheurs posent la question des risques inhérents à ce nouveau domaine : les maîtrise-t-on, les contrôle-t-on suffisamment ? Il s'agit d'abord de risques de sécurité et de toxicité pour les êtres vivants et l'environnement.
Mais il s'agit aussi de bouleversements sociétaux : l'usage de nanomédicaments et de nanotechnologies risque-t-il de nous orienter vers l'ère de l'homme augmenté, et par conséquent de profondément transformer la notion même de l'humanité ?
C'est la raison pour laquelle certaines institutions publiques nationales ou internationales préconisent, outre l'évaluation de la sûreté des produits nanomédicaux, de définir une éthique et une réglementation stricte autour de ces produits, si possible à l'échelle mondiale.
Fiche réalisée avec l'appui de Dr Nathalie Mignet, directrice de recherche au CNRS, présidente de la Société française de nanomédecine.
Extrait de Santé 2030 - Partie 2 : les vecteurs d'innovation.
Retrouvez l'intégralité de l'étude sur le site.

