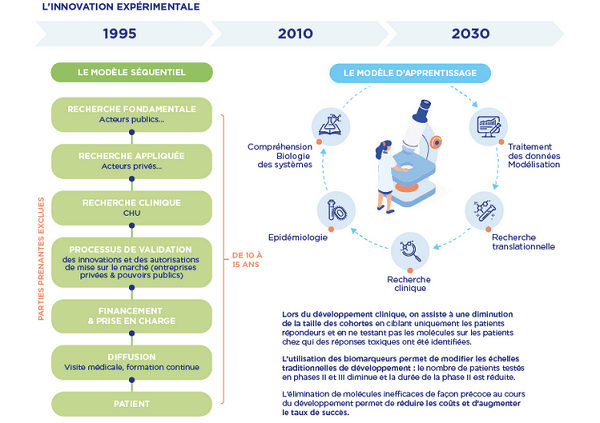
L’innovation expérimentale, nouveau modèle d’innovation ?
Il partira d’un modèle conceptuel, nourri par des bases de données partagées et par l’identification des cibles, pour revenir au patient puis au modèle conceptuel.
Le modèle humain prendra de plus en plus d’importance, à côté du modèle numérique, dans tous les domaines de la recherche fondamentale en sciences de la vie.
50 thérapies ciblées sont disponibles en oncologie (Source : Leem, « Santé 2030 »).
Contexte :
● Chercheurs, hôpital, industrie et patients sont en interaction continue pour trouver et adapter des traitements toujours plus ciblés et efficaces, à l’échelle de groupes réduits de patients, voire à l’échelle de l’individu.
Ce développement de solutions thérapeutiques, avec un nouveau paradigme, est déjà présent dans le champ de l’immunothérapie et de certaines maladies rares.
● Depuis la mise à disposition, en 1998, de la première thérapie ciblée (l’anticorps Herceptin indiqué chez certaines patientes atteintes d’un cancer du sein dont la tumeur présente une caractéristique moléculaire particulière), plus de 50 thérapies sont désormais disponibles.
Cette dynamique s’accélère puisqu’elle pourrait concerner la moitié des patients (contre 10 à 20 % actuellement).
● Cette dynamique nécessitera des changements majeurs en termes d’équipements, de prise en charge médicale, d’organisation, de modèle industriel.
En matière d’équipement, le plan France Médecine Génomique 2025 vise à faire émerger 12 plateformes de séquençage à haut débit, indispensables pour déterminer si les personnes sont à même de bénéficier d’une thérapie ciblée.
Enjeux :
● De plus en plus de médicaments ou solutions thérapeutiques permettant de soigner la maladie s’adresseront à une cible réduite ou très réduite de patients. C’est notamment le cas des médicaments orphelins ou de la médecine de précision.
Ces médicaments, qui bouleversent la prise en charge et la vie des patients, impactent aussi notre système de santé.
En effet, bien souvent, ils ne s’intègrent plus au schéma classique de la chaîne de valeur des produits de santé : les essais cliniques sont réalisés sur un très petit nombre de patients, les autorisations de mise sur le marché sont accordées sur la base d’essais cliniques plus courts, les prix et les remboursements sont plus complexes du fait du très petit nombre de patients et de coûts de R&D très conséquents, etc.
Ces solutions thérapeutiques nécessitent donc, pour leur pleine diffusion, une profonde transformation de notre écosystème de santé.
● L’émergence d’innovations allant au-delà des médicaments appelle, elle aussi, une adaptation de notre écosystème. En effet, les solutions multi-technologiques de santé ou l’algorithmie, par exemple, s’accompagnent de défis immenses.
● Il n’existe pas de cadre propice à leur développement et à leur diffusion : l’enjeu est donc bel et bien de prendre en considération les spécificités de ces nouvelles familles d’innovation, d’en anticiper l’impact sur nos modèles existants (R&D, production, accès au marché, commercialisation...), et de transformer notre écosystème pour favoriser leur développement.
● L’anticipation des innovations pour l’ensemble des parties prenantes du système de santé (régulateurs, organismes de financement, monde médical) devient indispensable.
Avec une analyse anticipée de deux à trois ans avant l’arrivée sur le marché des médicaments, ces outils permettront au public de mesurer la portée des innovations à attendre – les modèles les plus aboutis partageant les résultats publiquement – ; de préparer les nouvelles logiques d’évaluation des médicaments ; d’anticiper l’impact organisationnel, voire budgétaire, sur les systèmes de santé en place.
La question est de savoir à qui reviendra la coordination de ces systèmes de détection précoce de l’innovation. Au système public ? Aux acteurs industriels ? Au tiers indépendant des autorités et des industriels ?
Nos Actions :
● Face aux grands défis médicaux (de la connaissance aux traitements) qui résistent (maladie d’Alzheimer...) ou qui se développent (antibiorésistance...), les acteurs de la recherche et de l’industrie et les pouvoirs publics ont pris conscience qu’aucun d’eux ne pourrait apporter seul une solution à ces sujets très complexes, risqués et nécessitant le temps long.
● Les entreprises du médicament participent au développement de consortiums, qu’ils soient publics-privés ou privés-privés, au sein d’une approche plus ouverte de l’innovation, dans les phases dites précompétitives.
● Les entreprises du médicament participent notamment à l’Initiative européenne pour le médicament innovant (IMI), qui fonctionne sur la base d’étroites collaborations en amont entre centres de recherche, universités, entreprises du médicament, associations de patients et autorités de santé.

